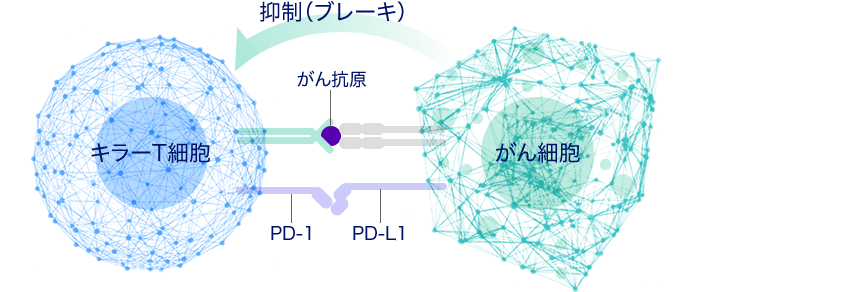
私達の体の中では、毎日3000個ほどの異常な細胞(がん細胞)が生じていると考えられています。 通常、体内の免疫システムによりがんの発症は抑えられています。 しかし、免疫チェックポイント分子による免疫抑制を利用して、この免疫システムから逃避すると、異常細胞は増殖し、がんとして診断されます。
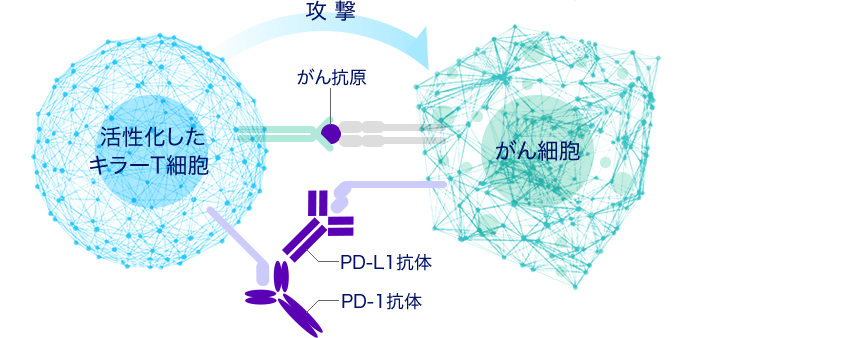
当センターの本庶佑センター長は、免疫チェックポイント分子による免疫抑制メカニズムの解明と免疫抑制解除による免疫療法を開発した功績により、2018年のノーベル生理学・医学賞を受賞しました。 PD-1(Programmed cell death-1)は、この免疫抑制メカニズムの鍵となる代表的な免疫チェックポイント分子として発見され、活性化したキラーT細胞に多く発現しています。 一方、がん細胞ではPD-1のリガンドであるPD-L1が多く発現しており、PD-1とPD-L1が結合することで、がん細胞の除去に必要なキラーT細胞の活性化にブレーキがかかります(図)。 PD-1やPD-L1に対する抗体は、これらの分子に特異的に結合することにより、PD-1とPD-L1の相互作用を阻害します。 その結果、キラーT細胞へのブレーキが解除され、再活性化することによりがん細胞を攻撃する能力が回復します。