メンバー
教員

本庶佑教授

特定准教授

特定准教授

特定教授

特定准教授
背景
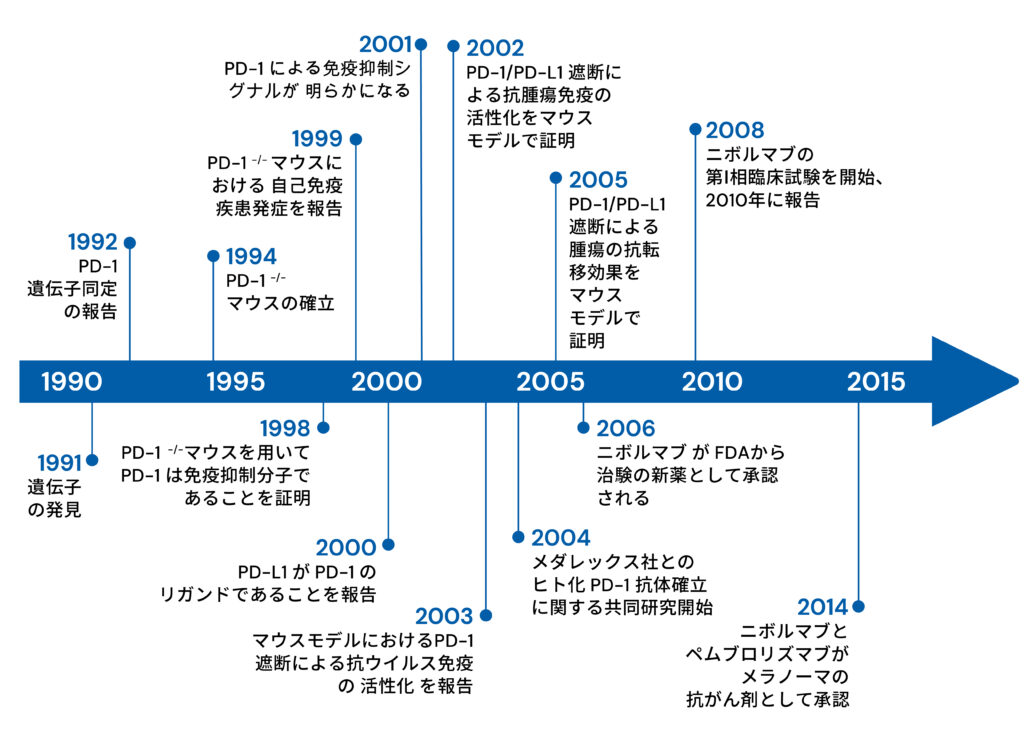
PD-1(Programmed cell death 1)は、T細胞の細胞死誘導時に発現が増強される遺伝子として1992年に当研究室メンバーであった石田博士らによって 単離・同定された。しかし、その機能は長い間不明であった。1998年に作製されたPD-1欠損マウスが脾腫、血中免疫グロブリンの増加、脾B細胞の抗IgM刺激 に対する反応性亢進等を来したことから、 PD-1は生体内において免疫反応を負に制御している事が明らかとなった。PD-1欠損マウスが発症する 自己免疫疾患は、マウスの系統により病態が異なり、C57BL/6系統では SLE様の腎炎・関節炎を発症し、BALB/c系統では拡張型心筋症を発症する。 これらのモデルを用いて、PD-1による自己免疫疾患の発症の解析を行ってきた。またPD-1シグナルを制御することで免疫応答をコントロールし、 自己免疫病を治療する方法の開発を進めてきた。
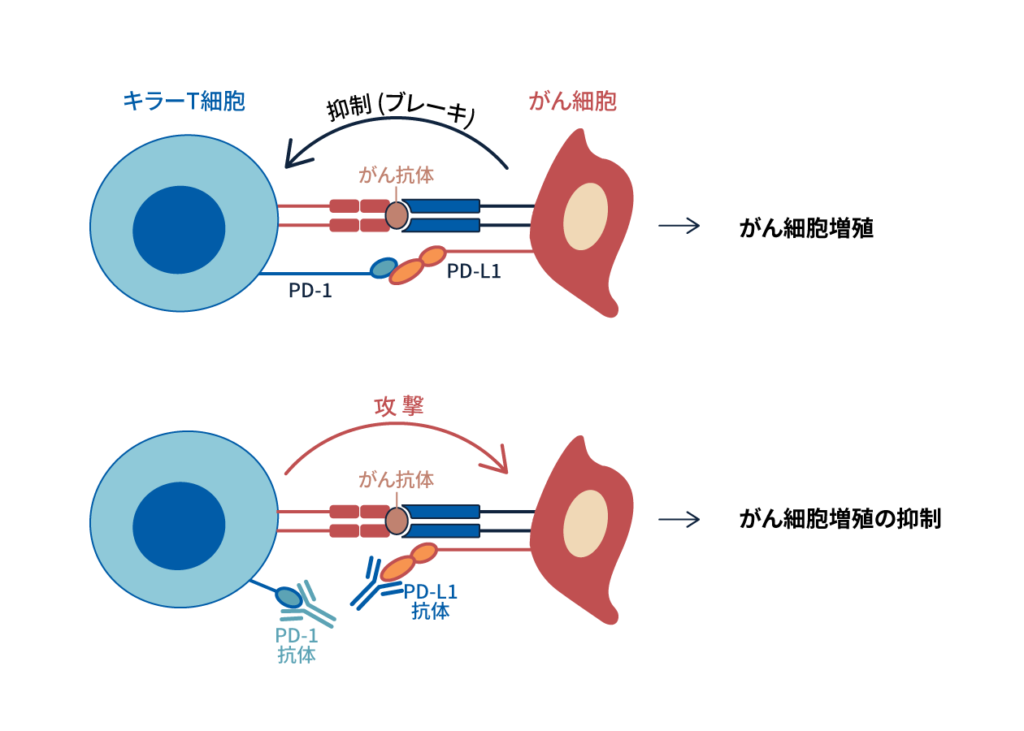
一方で当研究室ではPD-1シグナルを阻害することで腫瘍免疫を活性化できることを発見し、PD-1阻害抗体治療の臨床応用を世界に先駆け行ってきた。腫瘍は、従来自己組織の一部とみなされてきたため、自己と非自己の判別がつかず、免疫は腫瘍を拒絶できないと長い間考えられてきた。しかし、PD-1欠損マウスで自己免疫が発症するという事実は、PD-1シグナルをブロックすることで、 癌を攻撃できるという仮説を立てた。この仮説に基づき、PD-1抗体、もしくはPD-L1抗体を担癌マウスに投与すると、 抑制シグナルの解除と共にT細胞が活性化され、腫瘍増殖や、転移を抑制することが示された(図1)。
図1: PD-1/ PD-L1経路を介した阻害抗体による免疫治療
また腫瘍細胞がPD-L1を発現し、 免疫監視から逃避していることも明らかにしてきた。 ヒトにおいても予後の悪い癌患者の癌は、予後の良い患者よりもPD-L1の発現が高かった。これらの成果を基に、ニボルマブ(オプジーボ)を用いたがん免疫の臨床試験が2006年から実施された。2014年7月には国内外で初めてPD-1抗体が悪性黒色腫の 治療薬として認可され、現在では世界各地でPD-1抗体を用いた臨床試験が行われるに至っている。
現在の研究内容
PD-1の研究
従来の免疫療法と比較すると、PD-1抗体療法単独の奏効率は20-30%、がん腫によってはCTLA-4抗体との併用治療で、奏効率は50-60%と劇的に向上した。 しかし、なぜ残りの患者はPD-1抗体療法に不応答なのか、まだほとんどわかっていない。PD-1抗体治療のメカニズム解明を進めることで治療効果を増強させることができると思われる。またPD-1抗体応答性の患者と不応答性の患者を見分けるバイオマーカー開発も重要である。これらの目的のため、 臨床サンプルとマウスモデルを駆使し、PD-1阻害時における応答性、不応答性のメカニズム解明と、PD-1抗体治療の効果予測バイオマーカー探索を行っている(図1)。
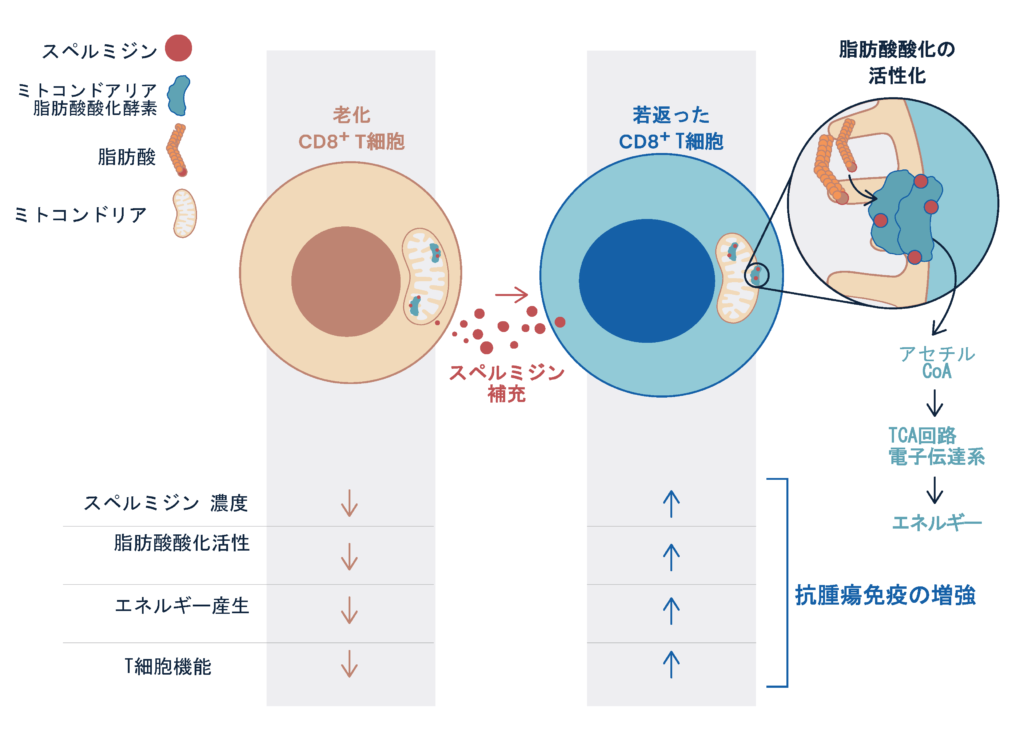
最近では、PD-1を介した免疫反応が、老化や代謝、ストレス応答と深く関与しており、生命の根幹的な恒常性の維持に重要であることもわかってきた。 例えばミトコンドリア代謝は、PD-1阻害抗体治療時においてT細胞機能を維持するのに重要な役割ことを明らかにした。マウスモデルでは、ミトコンドリア代謝、とくに脂肪酸酸化を促進するベザフィブラートやスペルミジンが、T細胞機能を促進しPD-1阻害抗体治療の治療効果を増強した。ベザフィブラートに関しては九州大学医学部呼吸器科との共同研究にてPD-1抗体との併用治療の第1相臨床治験を行い、EGFR変異陰性の肺がん患者にて生存(PFS)が伸びる可能性を示すことができた。またスペルミジンに関しては、脂肪酸酸化の酵素に直接結合することを実証し、ミトコンドリア代謝に深く関与していることを示した。T細胞は老化するとスペルミジン量が低下するため、ミトコンドリア機能が落ちること、スペルミジンの補充によりそれらは回復することも示した(Al-Habsi et. al. Science, 2022)。今後は、さらに免疫・代謝、ストレス応答を融合した新しい視点から、生命現象の原理を理解し、それらをがん免疫療法の改善に役立てる。
当研究室では分子生物学的、免疫学的実験手法と生命体の思想を学び、生命を全体像として捉える力を備えた自立した研究者を育てることを目標としている。世界の第一線で活躍し、免疫現象の根源的な問題に取り組もうとする志の高い学生やポスドクを随時募集している。
抗体遺伝子組換え機構の研究
感染症やワクチン接種に際して、Bリンパ球があらゆる抗原刺激に対応した抗体を産生できるのはなぜなのか。限られた抗体遺伝子配列を元に、無限に多種多様な抗体を産生する仕組みについて、本庶研究室は40年以上の間、その謎を解明する鍵となる知見を数多く発見した。1)抗体遺伝子がループを作り不要部分を環状DNAとして切り出すクラススイッチ組換え(CSR)の「欠失モデル」の提案(1978年)と証明、2)組換え領域の特異配列の同定(1980年)、3)CSRを起こすIL-4やIL-5のクローニング(1986年)といった成果を挙げた。
さらに、Activation-induced cytidine deaminase (AID、シチジン脱アミノ化酵素)を同定した(1999年)。AIDは脊椎動物全般に保存され、リンパ系胚中心の活性化Bリンパ球に限局して発現し、抗体遺伝子組換え、すなわち免疫記憶に必須である。ところが、AIDのターゲットがDNAか、RNAか、20年以上経った今も、明らかでない。教科書に記載されているDNA脱アミノ化仮説は、「放射線照射や薬剤暴露に起因するDNA修復研究」により発見された成果をベースにわずか2−3年で提唱された。その後、多くのAID研究者が報告した実験結果と、この古典的DNA仮説との矛盾や乖離がますます積み重なっている。
「一般的なDNA損傷修復」と「抗体遺伝子組換え」は、前者が、間違いなく元通りにDNA配列を修復するのに対して、後者は、「安全に」元とは異なる配列に繋ぎかえ、変異を入れる点で異なる。DNAの周囲には、損傷に備えて各種の修復機構がスタンバイしているのにも関わらず、それら修復機構が即座に活躍することを抑え、遠く離れたもう一方のDNA切断端と繋がり、また、「遺伝子変異」も残す。さらに驚くことに抗体遺伝子組換えはほぼ、がん化をもたらさない。これらの特徴には未解明の仕組みが潜むと考えざるを得ず、本庶研はこの疑問を解く研究を続けている。
例えば、AIDが2つの独立した機能、N末端依存性のDNA切断能とC末端依存性のDNAシナプス形成能・修復能を持つことを発見した(2003年)。また独自に、DNAトポイソメラーゼ1(Top1)がAIDの指令を受けて抗体遺伝子を切断する酵素であることを発見した(2009年)。そして、これらを支える特異的なクロマチン環境についても報告し、さらに探究している。
主な論文
PD-1
Chamoto, K., Yaguchi, T., Tajima, M., Honjo, T. Insights from a 30-year journey: function, regulation and therapeutic modulation of PD1. Nat Rev Immunol. 2023 Apr 25. DOI: 10.1038/s41577-023-00867-9.
Al-Habsi, M., Chamoto, K., Matsumoto, K., Nomura, N., Zhang, B., Sugiura, Y., Sonomura, K., Maharani A., Nakajima Y., Wu, Y., Nomura, Y., Menzies, R., Tajima, M., Kitaoka, K., Haku, Y., Delghandi, S., Yurimoto, K., Matsuda, F., Iwata, S., Ogura, T., Fagarasan, S., Honjo, T. Spermidine activates mitochondrial trifunctional protein and improves antitumor immunity in mice. Science. 28; 378 (6618): eabj3510. (2022). DOI: 10.1126/science.abj3510
Iwai, Y., Ishida, M., Tanaka, Y., Okazaki, T., Honjo, T., Minato, N. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. PNAS 99, 12293-7 (2002). DOI: https://doi.org/10.1073/pnas.192461099
Nishimura, H., Okazaki, T., Tanaka, Y., Nakatani, K., Hara, M., Matsumori, A., Sasayama, S., Mizoguchi, A., Hiai, H., Minato, N., Honjo, T. Autoimmune dilated cardiomyopathy in PD-1 receptor-deficient mice. Science. 2001 Jan 12;291(5502):319-22. DOI: 10.1126/science.291.5502.319
Ishida, Y., Agata, Y., Shibahara, K., Honjo T. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J. 1992 Nov;11(11):3887-95. DOI: 10.1002/j.1460-2075.1992.tb05481.x.
AID
Kobayashi, M., Wakaguri, H., Shimizu, M., Higasa, K., Matsuda, F., Honjo, T. Ago2 and a miRNA reduce Topoisomerase 1 for enhancing DNA cleavage in antibody diversification by activation-induced cytidine deaminase. Proc Natl Acad Sci U S A. 2023 May 2;120(18):e2216918120. DOI: 10.1073/pnas.2216918120.
Stanlie, A., Aida, M., Muramatsu, M., Honjo, T., Begum, N.A. Histone3 lysine4 trimethylation regulated by the facilitates chromatin transcription complex is critical for DNA cleavage in class switch recombination. Proc Natl Acad Sci U S A. 2010 Dec 21;107(51):22190-5. DOI: 10.1073/pnas.1016923108.
Begum, N.A., Kinoshita, K., Kakazu, N., Muramatsu, M., Nagaoka, H., Shinkura, R., Biniszkiewicz, D., Boyer, L.A., Jaenisch, R., Honjo, T. Uracil DNA glycosylase activity is dispensable for immunoglobulin class switch. Science. 2004 Aug 20;305(5687):1160-3. DOI: 10.1126/science.1098444.
Muramatsu, M., Kinoshita, K., Fagarasan, S., Yamada, S., Shinkai, Y., Honjo, T. Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell. 2000 Sep 1;102(5):553-63. DOI: 10.1016/s0092-8674(00)00078-7.
Honjo, T., Kataoka, T. Organization of immunoglobulin heavy chain genes and allelic deletion model. Proc Natl Acad Sci U S A. 1978 May;75(5):2140-4. DOI: 10.1073/pnas.75.5.2140.
全ての論文のリスト
採用情報&連絡先
やる気のある学生、博士研究員、技術スタッフを常時募集しています。
CCIIのお問い合わせフォームをご利用いただくか、recruit_ccii@mail2.adm.kyoto-u.ac.jpまで直接メールをお送りください。講座の名前をご記入ください。